Cancer Cell | 詹启敏团队合作研究揭示肠道微生物影响肠癌新辅助放化疗疗效的原因
直肠癌是全球癌症相关死亡的主要原因之一,约占所有癌症相关死亡的3.2%【1】。据统计,每年全球有超过70万的直肠癌新发病例,且超过30%是预后不良的晚期患者【2】。新辅助放化疗联合全直肠系膜切除术已成为局部晚期直肠癌(locally advanced rectal cancer)的标准治疗方法【3,4】,但不同的局部晚期直肠癌患者对新辅助治疗的敏感性不同,只有15-27%的患者能达到病理完全缓解(pathologic complete response),仍有20-40%的患者肿瘤退缩不明显甚至对治疗完全无响应【5,6】。因此,解析局部晚期直肠癌患者对新辅助放化疗响应异质性的机制,精准筛选对新辅助治疗响应的局部晚期直肠癌患者已成为直肠癌治疗领域亟待解决的重要临床及科学问题!
放化疗能通过破坏肿瘤细胞的 DNA 来控制其恶性增殖。双链断裂被认为是放化疗诱导的细胞杀伤过程中最主要的 DNA 损伤,肿瘤细胞对放化疗的敏感性在很大程度上取决于它们对放化疗所致的 DNA 损伤的修复能力【7】。DNA修复能力受微环境中各种代谢因素的影响。越来越多的证据显示,作为宿主新陈代谢的关键参与者,肠道微生物能通过诱发炎症和免疫反应影响结直肠癌的发生发展【8】,其菌群组成也被报道能影响肿瘤细胞响应治疗的敏感性【9,10】。然而,这些肠道菌群的改变如何影响直肠癌新辅助放化疗疗效及其内在的调节机制仍不清楚。
2022年12月22日,北京大学肿瘤医院詹启敏院士课题组和王维虎教授团队合作在Cancer Cell上发表题为Gut microbiota-mediated nucleotide synthesis attenuates the response to neoadjuvant chemoradiotherapy in rectal cancer的文章,从宿主-菌群相互作用角度,揭示了肠道微生物对局部晚期直肠癌新辅助放化疗疗效影响的分子基础。

研究团队首先纳入了126例在北京大学肿瘤医院放射治疗科接受新辅助放化疗的局部晚期直肠癌患者,收集了治疗前、中、后及疗效评估等不同阶段的353份粪便标本(图1),通过16s rRNA扩增子测序,发现新辅助治疗后直肠癌患者肠道微生物的多样性显著降低,并且在放化疗后的直肠癌患者肠道微生物中发现为肠道细胞提供关键能量来源的菌群丰度发生改变,从肠道微生物的角度拓宽了人们对直肠癌治疗中放化疗作用的理解。
为了进一步确定肠道微生物变化与患者放化疗响应的关系,研究团队根据NCCN肿瘤退缩分级指南和客观响应将患者分为响应和无响应组,通过宏转录组分析发现普通拟杆菌(Bacteroides vulgatus)和核苷酸生物合成通路在无响应组得到显著富集,肠道微生物的代谢组和靶向代谢物的丰度分析亦发现与核苷酸生物合成相关的代谢物在非响应组显著升高,多组学整合分析发现普通拟杆菌(B. vulgatus)对非响应组显著升高的核苷酸生物合成发挥了主导作用。
体外细胞实验证实核苷补充可保护肿瘤细胞免受5-氟尿嘧啶和电离辐射的损伤,通过阻断嘧啶或嘌呤从头生物合成,能降低肿瘤细胞的生存,而外源性核苷的补充能够抵消化疗药物对嘧啶或嘌呤从头生物合成的抑制,使得降低肿瘤细胞DNA双链损伤从而存活。进一步利用核苷转运蛋白的抑制剂阻断外源性核苷摄取能够减弱核苷混合物对5-氟尿嘧啶或电离辐射的保护作用,抑制电离辐射后DNA双链损伤的修复,证实了外源性核苷补充能够帮助肿瘤细胞从肿瘤治疗的打击中存活下来。
体内动物实验证明核苷的补充能有效降低小鼠皮下移植瘤电离辐射后的DNA损伤。为了更好的模拟临床患者结直肠肿瘤与肠道微生物之间的交互作用,研究团队进一步将MC38细胞接种到小鼠盲肠肠壁,建立了原位结直肠癌模型。发现普通拟杆菌(B. vulgatus)灌喂显著减弱了5-氟尿嘧啶对肿瘤治疗的效果,而这种减弱可以被核苷转运蛋白的抑制剂逆转。这些结果表明,普通拟杆菌(B. vulgatus)介导的核苷酸生物合成有助于原位结直肠肿瘤抵抗5-氟尿嘧啶治疗的损伤。
通过对直肠癌患者放疗后肿瘤组织的转录组进行基因集富集分析发现参与DNA修复和核苷转运相关的基因在无响应肿瘤中表达增加,靶向代谢物分析发现放化疗后无响应的直肠癌患者的血浆和肿瘤组织中与核苷生物合成相关的代谢物水平增加。血清中的尿酸是外源和内源性嘌呤分解的代谢物,其丰度会随核苷酸生物合成活性的变化而波动,研究团队进一步分析了735名患者的2205份血清样本,发现与响应者相比,在放化疗后无响应的直肠癌患者血清中尿酸水平升高,且血清尿酸水平与接受新辅助放化疗后局部晚期直肠癌患者的不良预后显著相关,提示血清尿酸水平是一个潜在的用于评估直肠癌患者放化疗预后的标志物。
综上所述,本研究发现普通拟杆菌(B. Vulgatus)介导的核苷酸合成能通过促进肿瘤细胞的DNA修复影响局部晚期直肠癌新辅助治疗的疗效,揭示了肠道微生物影响直肠癌新辅助治疗疗效的机制,证实了在肿瘤治疗过程中研究肿瘤细胞和肠道微生物交互作用的重要性。
北京大学肿瘤医院滕花景、王嫣和隋鑫为该论文的共同第一作者,詹启敏院士与王维虎教授为共同通讯作者。
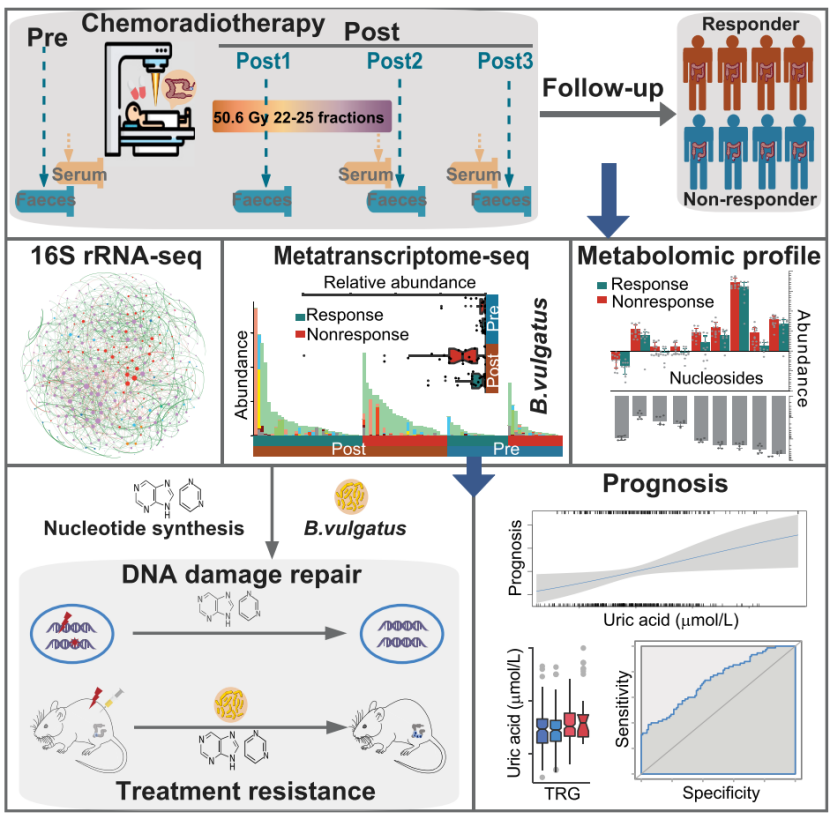
图1 研究流程及研究概要
1. Bray, F., Ferlay, J., Soerjomataram, I., Siegel, R.L., Torre, L.A., and Jemal, A. (2018). Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 68, 394-424.
2. Smith, J.J., and Garcia-Aguilar, J. (2015). Advances and challenges in treatment of locally advanced rectal cancer. J Clin Oncol 33, 1797-1808.
3. van Gijn, W., Marijnen, C.A., Nagtegaal, I.D., Kranenbarg, E.M., Putter, H., Wiggers, T., Rutten, H.J., Pahlman, L., Glimelius, B., van de Velde, C.J., and Dutch Colorectal Cancer, G. (2011). Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol 12, 575-582.
4. Roh, M.S., Colangelo, L.H., O'Connell, M.J., Yothers, G., Deutsch, M., Allegra, C.J., Kahlenberg, M.S., Baez-Diaz, L., Ursiny, C.S., Petrelli, N.J., and Wolmark, N. (2009). Preoperative multimodality therapy improves disease-free survival in patients with carcinoma of the rectum: NSABP R-03. J Clin Oncol 27, 5124-5130.
5. Sauer, R., Liersch, T., Merkel, S., Fietkau, R., Hohenberger, W., Hess, C., Becker, H., Raab, H.R., Villanueva, M.T., Witzigmann, H., et al. (2012). Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol 30, 1926-1933.
6. Sebag-Montefiore, D., Stephens, R.J., Steele, R., Monson, J., Grieve, R., Khanna, S., Quirke, P., Couture, J., de Metz, C., Myint, A.S., et al. (2009). Preoperative radiotherapy versus selective postoperative chemoradiotherapy in patients with rectal cancer (MRC CR07 and NCIC-CTG C016): a multicentre, randomised trial. Lancet 373, 811-820.
7. Chen, Y., Jiang, T., Zhang, H., Gou, X., Han, C., Wang, J., Chen, A.T., Ma, J., Liu, J., Chen, Z., et al. (2020). LRRC31 inhibits DNA repair and sensitizes breast cancer brain metastasis to radiation therapy. Nat Cell Biol 22, 1276-1285.
8. Cheng, W.Y., Wu, C.Y., and Yu, J. (2020). The role of gut microbiota in cancer treatment: friend or foe? Gut 69, 1867-1876.
9. Jang, B.S., Chang, J.H., Chie, E.K., Kim, K., Park, J.W., Kim, M.J., Song, E.J., Nam, Y.D., Kang, S.W., Jeong, S.Y., and Kim, H.J. (2020). Gut Microbiome Composition Is Associated with a Pathologic Response After Preoperative Chemoradiation in Patients with Rectal Cancer. Int J Radiat Oncol Biol Phys 107, 736-746.
10. Yi, Y., Shen, L., Shi, W., Xia, F., Zhang, H., Wang, Y., Zhang, J., Wang, Y., Sun, X., Zhang, Z., et al. (2021). Gut Microbiome Components Predict Response to Neoadjuvant Chemoradiotherapy in Patients with Locally Advanced Rectal Cancer: A Prospective, Longitudinal Study. Clin Cancer Res 27, 1329-1340.

